研究紹介
オートファジー(自食作用)
生命を維持するためには、一旦合成したタンパク質を適切に分解処理する必要があります。ユビキチン・プロテアソーム系が細胞質における選択的タンパク質分解の主役であるのに対し、オートファジーは細胞質成分をリソソームで分解するための主要分解機構です。オートファジーはタンパク質だけではなくミトコンドリアなどのオルガネラをも分解できる大規模なシステムで、多くの真核生物に備わっています。オートファジーでは約1μmの領域がランダムに包み込まれるため、オートファジーの基質は主に非選択的に隔離・分解されますが、一部の基質は選択的に取り込まれることもわかっています。
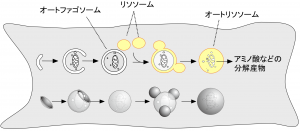
扁平な小胞(隔離膜やファゴフォアとも呼ばれる)が伸長・弯曲しながら細胞質の一部を取り囲みオートファゴソームとなる。次にオートファゴソームの外膜がリソソーム膜と融合するとオートリソソームとなり、オートファゴソームの内膜とともに内容物が分解される。
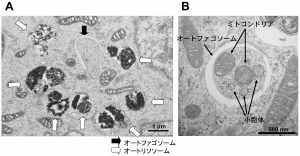
(A)栄養飢餓状態のマウス胚性幹細胞(長浜バイオ大学 山本章嗣博士(故人)撮影)
(B)栄養飢餓状態のマウス線維芽細胞(東京医科歯科大学(当時) 岸千絵子博士撮影)
これまでの研究成果
オートファジーの分子機構
オートファジーの分子機構は大隅良典教授(現・東工大)のグループを中心にした出芽酵母の研究によって大きく進展してきました。特にオートファゴソーム形成に関わるAtg分子群の解析がこの分野の突破口となりました。これらの中には、ユビキチン化と類似した特殊な翻訳後修飾システムがふたつも存在していたなど、驚くべき仕組みが隠されていました。
私たちはこれらの酵母Atgタンパク質のホモログを足がかりに、哺乳類細胞でのオートファジーの分子機構について解析してきました。特に、オートファゴソーム形成因子、オートファゴソーム・リソソーム融合因子の分子細胞生物学的解析を行っています。FIP200、ATG101、シンタキシン17、TMEM41Bなどの出芽酵母にはない分子装置も発見しています。
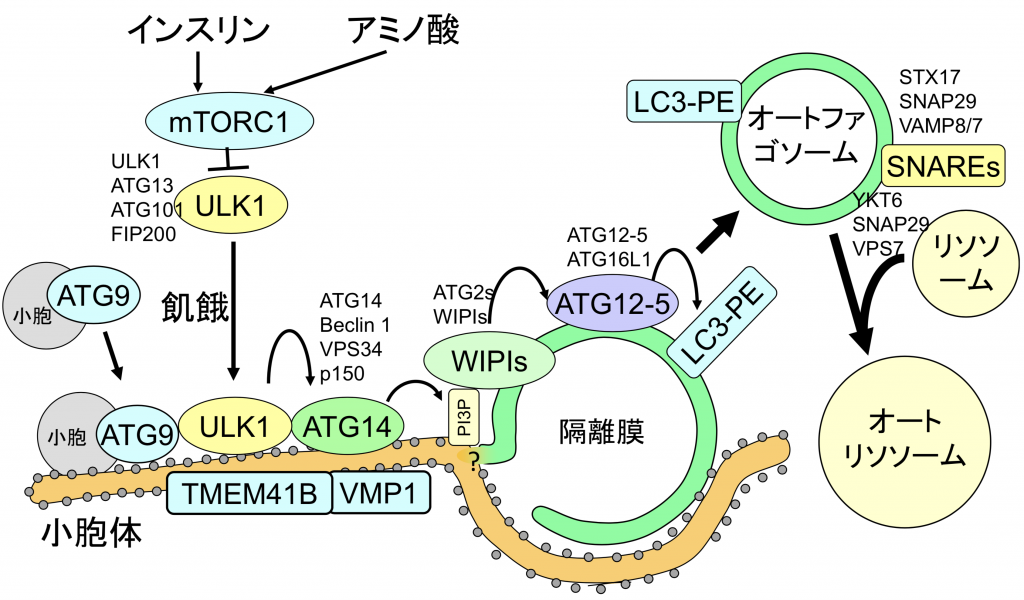
アミノ酸やインスリンはmTORC1複合体を介してオートファジーを抑制している。mTORC1はULK1–ATG13–FIP200–ATG101複合体と直接結合してオートファジーを抑制する。飢餓時にはULK1複合体は小胞体膜(あるいはその近傍)へATG9小胞とともに移動し、その下流ではATG14–Beclin 1–VPS34–p150複合体、ATG2-WIPI複合体、ATG12–ATG5–ATG16L1複合体、LC3 (Atg8ホモログ)などがオートファゴソーム形成において重要な役割を担う。オートファゴソームに接触している小胞体に存在する多重膜貫通タンパク質VMPとTMEM41Bがオートファゴソーム形成に必要である。その後完成したオートファゴソームにシンタキシン17(STX17)やYKT6がリクルートされ、リソソームとの融合を誘導する。
哺乳動物個体でのオートファジーモニター法の開発
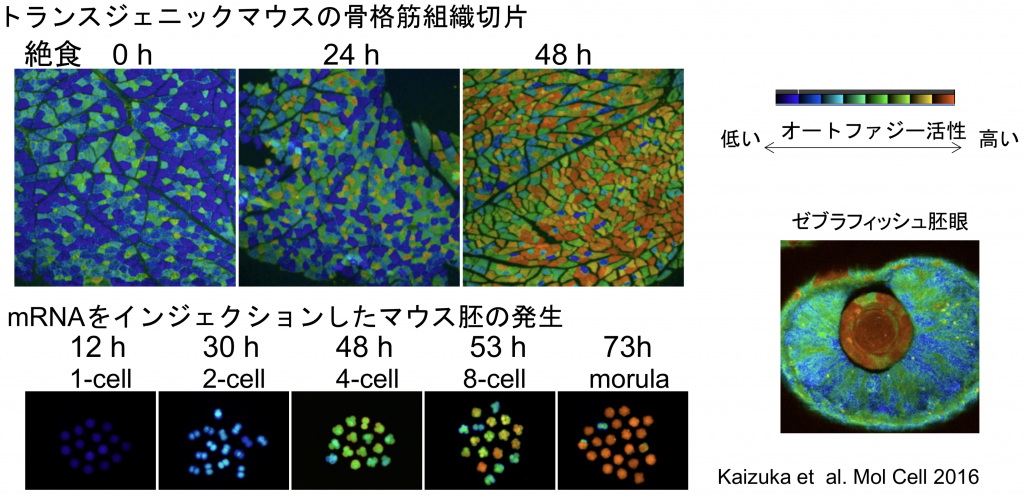
簡便かつ特異的にオートファゴソームを検出する目的で、全身のオートファゴソームが蛍光標識されるトランスジェニックマウス(GFP-LC3マウス)を作製しました(図4、5)。このマウスを用いることで、オートファジーは栄養飢餓に応じて神経系を除くほぼすべての臓器で顕著に活性化されることが確認されました。また、受精直後の胚でもオートファジーが活発化することもわかりました。より最近では、オートファジーによる分解活性を定量できる新しいプローブも開発しました(図6)。

オートファゴソームを標識するGFP-LC3を発現するマウス線維芽細胞をアミノ酸飢餓培地に移してから観察した例。小さなドットがオートファゴソームを示す。
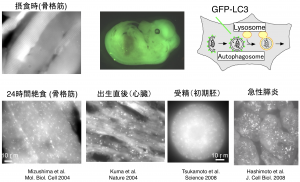
飽食時オートファジーはほとんどおこっていないが、24時間絶食後には脳を除くほとんどの臓器で顕著に誘導される。出生直後、受精直後、疾患モデルなどでもオートファゴソームが蓄積する。
哺乳動物でのオートファジーの生理的意義の解明
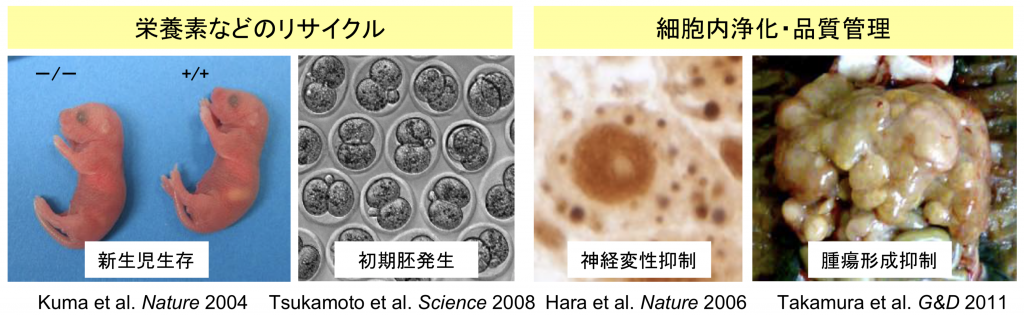
哺乳類におけるオートファジーの生理的役割を明らかにするために、オートファジー能を欠損するさまざまなマウスを作製しています。これまでの解析から、オートファジーは、新生児期に代表される飢餓適応、着床前の初期胚発生、細胞内浄化、神経変性抑止、腫瘍発生抑制に重要であることがわかっています。さらに、共同研究によって、オートファジーは細胞内侵入細菌の除去や抗原提示などのさまざまな機能があることもわかってきています。
-
オートファジーは飢餓適応に重要である(Atg5欠損マウス(全身型)を用いた解析)
オートファジーに必要な遺伝子Atg5を全身で欠損したマウスはほぼ正常に生まれるものの、生後まもなく深刻なアミノ酸不足に陥ります。マウス胎児は胎盤から栄養供給をうけていますが、出生とともに突然飢餓にさらされます。この時、全身でオートファジーを活性化して自己タンパク質からアミノ酸を産生し、飢餓に適応していると考えられます。(詳しい解説へ)
-
オートファジーは初期胚発生に必要である(卵特異的Atg5ノックアウトマウスの解析)
オートファジーは受精4時間後頃より活性化されます。この時期にオートファジーをおこせないマウス胚は、4-8細胞期で発生が停止してしまいます。マウス胚は母性タンパク質を分解することによって、この時期に必要なアミノ酸を獲得していると考えられます。(詳しい解説へ)
-
オートファジーには細胞内浄化作用・神経変性抑制作用がある(神経系特異的Atg5ノックアウトマウスの解析)
オートファジーには細胞内のクリアランス機能もあり、これがうまく機能しないと、細胞内に異常なタンパク質が蓄積します。例えば、神経特異的Atg5ノックアウトマウスは神経変性疾患を発症します。これはさまざまな神経変性疾患や老化とも関連する重要な機能です。(詳しい解説へ)
-
オートファジーには腫瘍発生抑制作用がある(Atg5モザイク欠損マウスの解析)
ATG5遺伝子を全身臓器でモザイク状に欠損するマウスを作成し、オートファジー欠損細胞の運命を全組織で長期間追跡したところ、肝で多発性腫瘍が発生しました。これはオートファジーによる不良ミトコンドリアや毒性タンパク質の除去不全の結果であると予想されます。(詳しい解説へ)
ヒト疾患との関連
ヒトの神経変性疾患のひとつ(SENDA病)でWIPI4遺伝子の変異がみつかり、オートファジーの活性が部分定期に低下していることが分かりました。(詳しい解説へ)
当研究室の課題
オートファゴソーム形成と成熟のメカニズム
オートファジーの不思議な膜動態のメカニズムはまだまだ解明されていません。私たちは、特に、(1)オートファゴソーム形成部位の解明、(2)選択的基質のリクルート機構の解明、(3)オートファゴソーム膜の伸長と形作りのメカニズムの解明、(4)オートファゴソームの成熟とリソソームとの融合機構の解明、を目指しています。アプローチとしては、細胞生物学、生化学、分子生物学、形態学、生物物理学、分子進化などを駆使しています。
オートファジーの生理的意義
オートファジーは一部のタンパク質やミトコンドリアなどのオルガネラを特異的に識別して分解することができることが最近の研究から判っており、このような選択的オートファジーの役割は基質の性質を考えることで理解できます。しかし、ほとんどの基質はランダムに分解されており、この機能は種を超えて保存されています。これらを総合して、マウス、ゼブラフィッシュ、原虫、酵母などを用いながら分野横断的研究を展開し、オートファジーの真の役割の理解に迫ります。
モニター系の開発
GFP-LC3マウスやGFP-LC3-RFP-LC3プローブの開発は有効な研究ツールを提供しましたが、まだ完全ではなく、いろいろな問題点も含んでいます。より普遍的なオートファジーの定量方法の開発を試みています。
疾患とのかかわり
オートファジーを検出できるマウス、オートファジー機能を抑制したマウスなど、さまざまな研究ツールが揃いました。これらを用いて、オートファジーが関わる疾患、あるいはオートファジーを用いて制御することのできる疾患などを探しながら研究していきたいと考えています。
当研究室の研究ツールは広く分与していますので、ご入り用の方は下記のリンクをご覧下さい。
さらに詳しく知りたい方へ
オートファジーの生理機能・病態との関連
Mizushima, N., Komatsu, M. Autophagy: renovation of cells and tissues. Cell 147:728-41 (2011).
オートファジーの分子機構
Mizushima, N., Yoshimori, T., Ohsumi, Y. The Role of Atg Proteins in Autophagosome Formation. Annu. Rev. Cell Dev. Biol. 27:107-32 (2011).
オートファジーの検出方法
Mizushima, N., Yoshimori, T. and Levine, B. Methods in mammalian autophagy research. Cell 140; 313-326 (2010)
専門書
水島昇、吉森保 編集
「The オートファジー 研究者たちの集大成が見える最新ビジュアルテキスト(実験医学増刊35巻15号)」
羊土社 2017年
大隅良典監修、吉森保、水島昇、中戸川仁編集
「オートファジー 分子メカニズムの理解から病態の解明まで(The Frontiers in Life Sciences)」
南山堂 2017年
水島昇、吉森保 編
「オートファジー: 生命をささえる細胞の自己分解システム (DOJIN BIOSCIENCE SERIES)」
化学同人 (2013)
一般書
「細胞が自分を食べる オートファジーの謎」
(水島昇著PHPサイエンス・ワールド新書 2011年)

