最近の論文発表(原著)
小胞体オートファジーレセプターTEX264のカゼインキナーゼによるリン酸化 (Chino et al., EMBO Rep)
2022年04月20日 最近の論文発表(原著)
Haruka Chino, Akinori Yamasaki , Koji L Ode, Hiroki R Ueda, Nobuo N Noda, Noboru Mizushima
Phosphorylation by casein kinase 2 enhances the interaction between ER-phagy receptor TEX264 and ATG8 proteins
EMBO Rep. 2022 Apr 13;e54801. DOI: 10.15252/embr.202254801
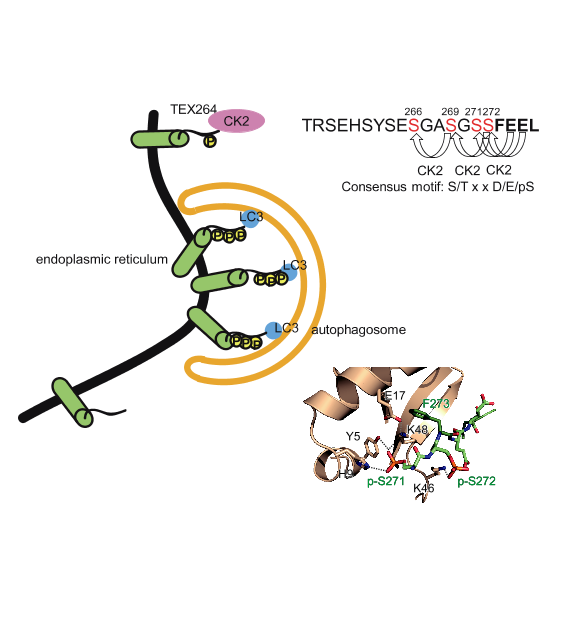
私たちは2019年に新規の小胞体オートファジー(ER-phagy)レセプターTEX264を同定しました。TEX264は小胞体膜タンパク質で、オートファゴソーム膜のLC3/GABARAPファミリータンパク質と結合するLC3結合部位(LIR)を有し、それを介してオートファゴソーム上に小胞体を誘導します。しかし、TEX264のLIRに存在する高度に保存されたセリン残基の意義やLC3/GABARAPとの結合の構造解析に関しては未解明でした。
今回、私たちはTEX264のLIRのセリン残基がカゼインキナーゼによりリン酸化されること、そのリン酸化がLC3/GABARAPファミリーとの結合とER-phagy機能に必要であることを発見しました。GABARAPL1との結合構造解析の結果からTEX264のLIRのリン酸化セリンはGABARAPL1との間に水素結合を形成し、それによってより強固な結合が可能になることが分かりました。他のER-phagyレセプターはLIRのC末端にαヘリックスを持つことでLC3との強い結合を可能にしていますが、C末端αヘリックスを持たないTEX264はLIRのリン酸化セリンによって他のER-phagyレセプターと同様の強い結合を可能にしていることが分かりました。本研究は選択的オートファジーレセプターとLC3/GABARAPとの結合様式に関する新たな知見をもたらしました。
本研究は、微生物化学研究所(現 北海道大学遺伝子病制御研究所)の野田展生教授、山崎章徳博士、東京大学大学院医学系研究科機能生物学専攻システムズ薬理学教室の上田泰己教授、大出晃士講師と共同で行いました。