最近の論文発表(原著)
Haloタグを利用したパルスチェイス可能なオートファジー活性レポーターの開発 (Yim et al., eLife)
2022年08月16日 最近の論文発表(原著)
Willa Wen-You Yim, Hayashi Yamamoto & Noboru Mizushima
A pulse-chasable reporter processing assay for mammalian autophagic flux with HaloTag
Elife. 2022 Aug 8;11:e78923. doi: 10.7554/eLife.78923. Online ahead of print.
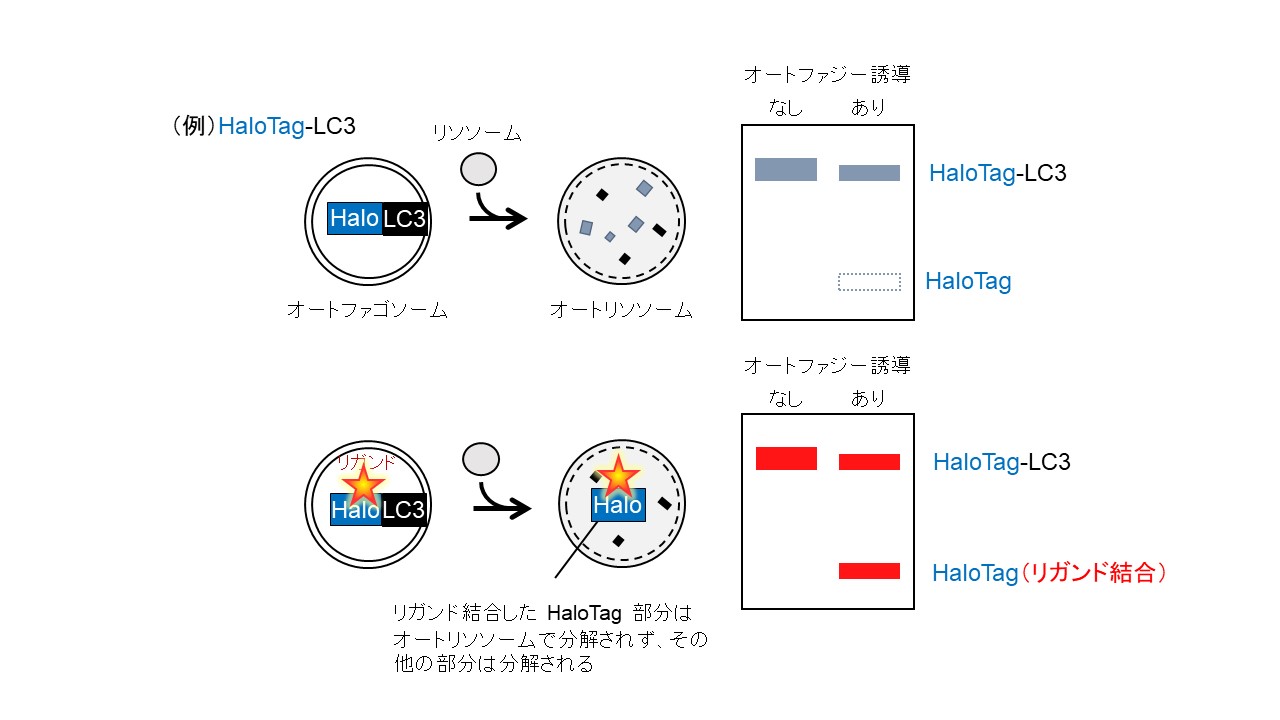
オートファジーの研究を進めるには「オートファジー活性」を測定する必要がありますが、哺乳類細胞では簡便で定量性の高いオートファジー活性測定法がないというのが現状でした。私たちは、HaloTag (Promega) にリガンドが共有結合するとリソソームでの分解に耐性になることを発見し、これを利用して新たなオートファジー活性定量法を開発しました。オートファゴソーム膜タンパク質LC3などにHaloTagを付加したレポーターを細胞に発現させると、リガンドを添加しない場合(図上段)はHaloTagがリソソーム内で分解されますが、リガンドを添加した場合(図下段)はHaloTag部分がリソソーム内に蓄積し、その量によってオートファジー活性を見積もることができます。また、HaloTagをGFPに融合させたHalo-GFPを用いると、サイトゾルタンパク質のランダムな分解を定量することができます。これによって、LC3などに依存していた従来法とは異なり、非選択的オートファジーを評価することができるようになりました。
この方法は以下のような多くの利点を備えています。
- 簡便で、かつ高感度で定量性が高く、ダイナミックレンジも広い
- パルスチェイス実験が可能
- 従来法で必要だったリソソーム阻害剤処理との比較が不要
- HaloTagレポーター全長が内部標準になるため従来法で必要だった外部標準が不要
- 任意のタンパク質にHaloTagを付加することで選択的オートファジーのレポーターとして利用できるなど汎用性が高い
本論文では以下のような様々なタイプのレポーターを作成してオートファジー活性の定量を行いました。
- 一般的なオートファジー定量レポーター(LC3依存性レポーター)
Halo-LC3, Halo-GFP-LC3, Halo-GFP-LC3-RFP
- オルガネラ選択的オートファジー定量レポーター
Halo-GFP-KDEL(小胞体分解), pSu9-Halo-GFP(ミトコンドリア分解)
- 完全に非選択的なオートファジー定量レポーター(LC3非依存性レポーター)
Halo-GFP
これらのレポーター発現プラスミドはAddgene (https://www.addgene.org/browse/article/28225176/) にありますので是非ご利用ください。