発表論文
エッセイ
弓の真相
水島昇 蛋白質 核酸 酵素,48, 1407-1411 (2003)より転載
女神か悪魔か
実は小学校の卒業文集には密かに、将来は「医者」か「科学者」になりたいと書いていた。しかしこの二つの間にある「か」が困りもので、これがなかなかとれなかったのである。物理学や数学的な考え方は非常に肌にあっていたので、そちらを選択する手もあった。しかしながら中学、高校時代、生物について考えることがほとんどなかったため、大学では医学部に進んで生命科学を学んでみようというのがもくろみだった。卒後2年間はふつうの内科医師として働いた後に(自分で言うのも何だが、注射は上手かった)、内科学の教室で大学院時代を過ごした。そこでは自己免疫疾患と考えられている膠原病の免疫異常についての研究が主であった。
当時はアポトーシスの研究が今にも増して盛んであった。特に、自己免疫疾患モデルマウスの原因遺伝子であるlpr遺伝子がFasをコードしていることがわかったことなどもあって、免疫学分野は細胞死研究で湧いていた。私自身の研究テーマはやや離れており、アポトーシスはかじった程度に過ぎなかったが、細胞死によって生体が制御されるということには非常に興味をそそられた。というのも、もともと生物の恒常性、安定性、秩序というものに興味をもっていたからである。生物は安定な存在ではあるが、いうまでもなく私達人間はものを食べて、排泄し、多大なエネルギーを消費している。つまり生体は安定ではあるけれども決して外界に対して閉じてはおらず、このような系は開いた平衡系と呼ばれている。体の細胞も数ヶ月のうちにほとんどが入れ替わり、細胞内のタンパク質に至っては長寿命タンパク質と呼ばれるものでさえその平均寿命はたかだか約2日に過ぎない。漠然とではあるが、このような新陳代謝に生物らしさを感じていた。(関係ないが、単一遺伝子疾患以外の複雑な病気が、何故ほぼ似た表現型として多くの個体に再現されうるのか、というのも当時から不思議に思っていることのひとつある。)
とにかく細胞死研究を羨ましく思っていたのは事実であり、大学院終了時にはその分野の留学先にいくつか手紙を書いていた。断られたり、返事がなかなか返ってこなかったりで決まらなかった頃に、ひとつの新鮮な総説を読んだのである。悪魔のささやきであったかも知れないそれは、大隅良典教授の酵母オートファジー(自食作用)の小さなレビューであった(参考文献1)(以前他のコラムでこれを女神と例えたらあまり評判が良くなかった)。酵母を用いて、オートファジー不能変異株を取得し、その原因遺伝子をクローニングしつつあるが、どれもよくわからないものである、といういかにも「ささやき調」の論文であった。タンパク質分解がプロテアソームやリソソームで行われていることは何となくは知っていたが、オートファジーという言葉は正直なところそれまで聞いたことがなかった。オートファジーとは細胞質の一部をリソソームに運んで消化するシステムである(参考文献2)。基本的には非選択的な分解系であり、酵母を含む全真核生物に保存されている。つまり細胞はタンパク質を合成している一方で、分解しながら細胞にとって良い状態を維持しているのである。温泉でお湯を注ぐ一方で、湯船からこぼすことによって、お湯をきれいに保っているようなものである。非特異的な方が効率よい新陳代謝の場合もあるであろう。アポトーシスの繁栄を例にだすまでもなく、モデル生物の遺伝学をもとにして生命科学のひとつの分野が形成されていくことにもあこがれを持っていた。予期しなかった出会いであったが、オートファジー研究に参加しようと決心するまでは、ほとんど時間を要しなかった。ここでやっと小学校の作文の「か」がとれたのである。学部卒後6年目であった。これが挑戦であったのかも知れないが、少なくても本人にとっては全く自然な流れであった。
セレンディピティ
幸いなことに、希望通り大隅研究室に加わることが許され、オートファジー研究を早速スタートした。「内科の医者が酵母をやるなんて・・」とよく言われたが、two-hybridスクリーニングなどの影響で出芽酵母はもはや大腸菌に次いで身近な単細胞生物ともいえる。それより、総説で眼にしたApgタンパク質の研究をこんなにもすぐに行えることを素直に喜んだ。私がはじめたのは当時ちょうどクローニングが終わったばかりのApg12というタンパク質であった。186アミノ酸からなるこの小さなタンパク質が全く予期しない展開を迎えることになった。
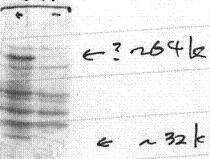
Apg12のN末端にMycタグを付加したものをapg12欠損酵母細胞に発現させ、その細胞抽出液を抗Myc抗体 (9E10) をもちいてウェスタンブロットを行った(1997年7月17日)。右のレーンはMyc-Apg12を発現させていない細胞をもちいたコントロール。~32 kと書き添えてあるバンドが本来のApg12である。「?」印のバンドが謎のバンドで、もちろんこのとき筆者はこのバンドの重要性にまったく気がついてい ない。全体にとても汚いが、言い訳をすると、これは抗Myc抗体(9E10)は酵母では非特異的バンドが多いことによる。その証拠にタグをHAに換えるこ とでずっと改善した(文献3参照)。
一次配列からは何の情報も得られなかったので、Apg12のN末端をMycエピトープで標識して発現制御や細胞内の局在などの標準的な解析をとりあえず行うこととした。実は、もしここでC末端に標識をつけていたら以下の発見はなかったかも知れない。まずはちゃんとMycエピトープがついたかどうかを調べるためにウエスタンブロットを行った。結果は図1に示すように非常に汚いもので、落胆した。しかし、それにしてもまだ妙であった。Apg12と思われるバンドは確かにあるのだが、それ以外にまだ特異的なバンドがありそうなのである(図1の?印)。Apg12にしかタグを付けていないのだから他にバンドがあるはずがない。リン酸化などの通常の翻訳後修飾でこんなにまで大きな差がでるのであろうか? きっとアーティファクトに決まっている。どのようなアーティファクトでこのような結果が出うるものかと、いろいろな可能性を考えたり、試したりした結果の結論は、「とりあえず保留にしてさきに進もう」というものであった。せっかくの魚を一度は海に放してしまったのである。しかし、並行して単離に成功したApg16がこのバンドのタンパク質に特異的に結合すること、 apg5, apg7, apg10変異株ではこのバンドが消失することなどから、この?バンドはアーティファクトではなく、これこそが重要であることがわかった。この間やく4ヶ月であり、なんとか大きな怪我にならなくて済んだ。すぐにこのバンドがApg12とApg5の共有結合体であることがほぼ明らかとなった(参考文献3)。さらに 驚くべき事は、Apg12とApg5が共有結合する方法が「ユビキチン化」とよばれる修飾様式と非常に似ていたことであった。ユビキチンとは分解標識としての働きが最も良く知られており(他にもさまざまな役割があることがわかっているがここでは省略)、ユビキチンが共有結合したタンパク質はプロテアソームに認識されて分解される。これは選択的タンパク質分解の鍵となるメカニズムである。オートファジーは非選択的分解機構であるが、そこにもユビキチンと同じ様な結合システムがあったのは全く驚異であった。これは単なる偶然であると今は理解しているが、タンパク質分解の領域では大きな反響を呼んだ。実際、それは「ユビキチン様タンパク質」という概念の成立にも貢献したと思っている(参考文献4)。

Apg12はC末端のグリシンを介してApg5に共有結合している。この結合体は弓のようにわん曲しながら細胞質を包み込む隔離膜へApg16とともに局在化する。Apg5は隔離膜が伸長するのに必須である。最後に隔離膜の端が融合して直径約1マイクロメートルのオートファゴソームが完成する(詳しくは文献4参照)。つまりオートファゴソームが細胞質の一部をがぶりと食べるわけである。この様子は専門家向けページでも公開している。
詳細はここでは触れないが、Apg12はC末端のグリシンを介してApg5と結合している(図2)。もしC末端にMycタグを付加していたら、このグリシンが隠されてしまってApg5と結合できなくなる。つまりこのシステムは発見し得なかったかも知れない。よって、N末端にタグを付加したのは幸運で、それだからこそこの結合系を発見できたのである。と、喜ぶのは実は誤りである。本来はN末端とC末端とにそれぞれタグを付けたものを両方作製するべきであった。N末端のタグではみえる高分子量の?バンドが、C末端のタグではみえないということからC末端になにかが付いていることにより早く気づいた可能性が極めて高いからである。
オートファジーへ!
Apg12結合システムは、確かに驚異的でかつ興味深いものであった。このシステムの発見にたずさわれたのは幸せ以外のなにものでもなかった。しかし、注目されていたのはその結合反応であり、オートファジーにおける役割についてはほとんどなにもわからなかった。オートファジー研究を志して大隅研究室に来た私にとっては違和感があった。このApg12システムを早くオートファジーの枠組みにはめたいという思いがあったのは当然である。またもうひとつ大隅研究室に参加した当初から考えていたことは、将来的には多細胞生物、できればこれまで馴染んできた哺乳動物でオートファジーの研究を展開したいというものであった。ここでまたいくつか幸いしたことがあった。Apg12結合システムは哺乳動物でもよく保存されており、かつApg12もApg5も哺乳動物ではホモログがひとつずつしか存在せず、遺伝子ノックアウトの対象として適していたことである(Apg遺伝子の多くは高等動植物ではホモログが数個存在する)。
このようなわけで大隅研に参加して3年目より本格的に哺乳動物細胞をもちいた研究を開始した。行った実験は技術的にはまったく月並みではあったが、私にとっては貴重な情報をもたらした実験が二つあった。ひとつは、両染色体のApg5遺伝子を破壊することによってオートファジー能を欠損したES細胞を作製した実験である。これが実はほとんどフェノタイプがないのである。この事実は酵母オートファジー不能株と同じであり、オートファジーが大規模な分解系とは言われているものの、少なくても猛スピードで分裂している細胞が生存するにはオートファジーは不要なのである。しかしショウジョウバエなどのモデル生物ではオートファジーが発生過程に必要であることが示唆されており(私達も現在マウスで解析中である)、おそらく細胞レベルというより、個体レベルでの生体秩序の維持に、この基本的な分解系はより重要なのであろう。
もうひとつはGFPを使った細胞内可視化技術で、オートファゴソームが細胞質を食べる現場がリアルタイムで自分の目で見えたことである。これも実はまったく期待していなかったことである。別の目的で作製したGFP融合ヒトApg5タンパク質を安定に発現するES細胞を試しに蛍光顕微鏡でみると、細胞内に多数の輝点として観察された。しかも、よくみると小さな輝点が徐々に伸びながらまがっていき、ちょうど視力検査表のリングのようになっていくようにみえた(図2)。当時、オートファゴソームの大きさはとても小さくて電子顕微鏡以外ではその構造をとらえることはできないという先入観があった。なので、 GFP-Apg5の輝点が弓のようにわん曲して伸びるようにみえても、「おーっ オートファゴソームができているところがみえる!」とみんなで冗談のつもりで言っていたほどである。ところが、その視力検査リングの両端が融合してリングとなるのところまでいくと、もはやオートファゴソーム形成の現場をみていると信じざるを得なくなった。この約10分の経過をビデオにまとめたところ、筆者が電子顕微鏡観察で大変お世話になっている山本章嗣先生(現・長浜バイオ大学・教授)から「生きているうちに見られるとは思わなかった」とのコメントをいただいた。それまで電子顕微鏡でしかとらえることの出来なかったオートファジーが、急に身近な存在になってきた。電子顕微鏡で見えていたものが、単に違う方法でみえるようになっただけではあるが、自分の目で現象をみることはすさまじい迫力で私達の知覚系に働きかけ、それを刺激する。誤ったイメージを擦り込むこともあるだろうが、それも承知の上でメリットを利用すればよい。エスカレートした筆者らは、全身のオートファゴソームが蛍光標識されるトランスジェニックマウスを最近作製し、さまざまな組織でのオートファジーの進行具合や誘導条件などを解析している。ただし、顕微鏡をあまりに長く見過ぎると、帰りの夜空の星さえも弓状やリング状にみえるようになってくる。

なでると幸運が訪れるといわれているJohn Harvard像の靴を触るふたり.ハーバード大学で.
「その他」の問題
このように幸いなことにオートファジー研究を楽しむことができているが、学会のたびに少し困ることがある。国内外を問わずある程度の規模以上の学会では、抄録提出時に適切な発表分野を選択するのが普通である。これがなかなか難問なのである。「細胞内オルガネラ(その他)」、「小胞輸送(その他)」、「タンパク質分解(その他)」などが妥協策であるが、栄養学的な問題などを扱おうと思えばこの限りではない。どこに出すかをあらかじめ研究室の中でも協議しておかないと、みんなバラバラのセッションでの発表となってしまうこともある。演題を出す方が困るくらいなので、殊勝にももし探される方々がいらっしゃるなら、きっとご迷惑をおかけしていることと思う。反面、さまざまな分野の方々とお知り合いになることができるのは利点でもあるが、ホームグラウンドがないのもおそらく事実である。
そのような私を仲間としてひろって頂いたのが大嶋泰治総括のさきがけ研究「素過程と連携」領域であった。ちょうどApg12結合システムのほぼ全容が明らかになった1999年から2002年までの3年間多大なサポートを頂いた。この研究領域には個人研究を行う38名の研究者が集まった。分野、手法、生物種(研究者の方ではなく研究対象)が異なる研究者がこれだけ集まって議論を深めるというのは本当に貴重な体験であった。なかには、私と同様特定のホーム分野を持たないように見受けられる研究者もいる。昨今国民へのアカウンタビリティの観点から明確な戦略目標を掲げるグラントが増えてきている。そのようなタイプの研究費の必要性は全く賛成ではあるが、過度にそれに偏るのは既存の研究分野の枠組みにはまらない研究の機会を奪うことになりかねない。さきがけ研究で研究費以外にも大きな財産をいただいた身として、さきがけタイプの研究支援システムのメリットを声を大にして主張したい。このシステムはあまり他国に例のない日本独自の優れたものであるにもかかわらず、表面上その姿を消すことになったのは本当に残念である。文部科学省、科学技術振興事業団にその精神が残っていると信じている。
生物学で証明??
今後も生命科学分野で研究を続けていきたいと考えているが、どうしても気になることがあるので、この際書いてみたい。私達の生命科学分野で「・・・ということが証明されました。」とか「・・・を証明するために・・・をしました。」というようなことを非常にしばしば耳にするが、これは絶対に間違っている。私の知っている限り、生物学で物事を証明できるような方法はない。物理学においてでさえ証明という言葉を使うのは困難であるし、厳密なことを言えば数論以外ではあり得ない。これは単に言葉尻の問題ではない。いかに実験科学がアーティファクトとの戦いであるかが軽んじられているように思う。極論すれば実験すること自体がアーティファクトである。針を刺したり、細胞を溶かしたり、あるいは顕微鏡ステージのうえで信じられないような強さのレーザー光線を浴びせたりする訳である。これらはわかりやすい方であるが、実際はもっと気がつきにくいアーティファクトが山ほどあって、その多くを見逃しているのだと思う。完全無欠のコントロールもあり得ない。互いに矛盾のある結論を提示している論文は数限りなくあるが、それらの多くはきっと実験自体が間違っているのではなく、残念ながらアーティファクトに気づいていないのではないか思う。特に自分にとって好都合な結果が出たときは要注意である。いかにももっともらしい実験結果は、ひとの思考をとたんに停止させることができる。これは「ミスリーディング(misleading)」と呼ばれ、真相を見破られないようミステリー小説作家があえて利用する手法でもある(参考文献5)。
さて、アーティファクトをゼロにすることが出来ない以上、ある程度のところで妥協せざるを得ないのも確かである。その線をどこに引くかこそが研究者に委ねられている重要な役割である。よく「自分の実験データを信じて突き進め!」というようなことを聞くが、これだけだと誤りだと思う。アーティファクトに気づくチャンスをもっとも持っているのは実験者本人である。その一挙動一挙動が問題になるわけである。データが他人のところへ回ったり、論文として発表されたりするにつれて、アーティファクトに気づく機会は極端に減っていく。つまり、自分が実験をやったというだけを根拠にデータを信じるのはむしろ反対の行為である。自分がやった実験だからこそ、どこにどれだけのアーティファクトが入りうるかを常に考えられるような研究者でありたい。私はアーティファクトの入りうる実験系を否定するつもりは決してない。繰り返すが、それは不可能である。むしろ、そのことを十分に理解してつきあうべきである。それをも含めてアーティファクトへの挑戦である。
おわりに
海のものとも山のものともわからぬ筆者を快く受け容れて頂きました大隅良典教授にはその後の研究生活一貫してご指導頂いており、心から感謝申し上げま す。また筆者が大隅研で哺乳動物の研究を行えたのは、吉森助教授(現・遺伝学研究所教授)のつくられた研究環境とご指導があってのことでありここに深謝い たします。さらに学部学生、大学院生時代を通じてお世話になりました、東京医科歯科大学、旧第一内科の宮坂信之教授には人手不足の医局状況にもかかわらず 私のわがままを許して頂き、自分の興味のままに研究を行うことが出来たのも宮坂先生の寛仁なご理解があってのことと深く感謝いたします。
なお、このようなエッセイを書くのは不慣れなため、一部、定年を間近に控えた回想のようになってしまった点をお詫びします。まだまだ研究を続けます。なお最後になりますが、このエッセイの約10%はアーチファクトあることを申し添えます。タイトルを含めて。
文献
- 参考文献1 大隅良典:生化学 69, 39-44 (1997)
- 参考文献2 水島昇、大隅良典:蛋白質核酸酵素 44, 865-873 (1999)
- 参考文献3 Mizushima, N., Noda, T., Yoshimori, T., Tanaka, Y., Ishii, T., George, M. D., Klionsky, D. J., Ohsumi, M., Ohsumi, Y. : Nature, 395, 395-398 (1998)
- 参考文献4 水島昇:生化学 74, 523-537 (2002)
- 参考文献5 森博嗣:封印サイトは詩的私的手記 幻冬舎 pp452 (2001)
著者プロフィール
1996年東京医科歯科大学大学院医学研究科修了(医学博士)。1996-1998年日本学術振興会特別研究員、1998-1999年基礎生物学研究所非常勤研究員、1999-2002年さきがけ研究21「素過程と連携」領域専任研究員。2002年から基礎生物学研究所助手、さきがけ研究21「タイムシグナルと制御」領域研究員(兼任)。趣味はテニス、ミステリー小説、音楽であるが、全盛期に比べるとそれぞれ1/3、1/10、1/30程度に落ち込んでいてとても悲しい。もともと無い筋肉がさらに無くなると筋肉痛にもならなくなることを発見。最近は逃避をかねて博物館巡りにも精を出す。今後は生命体の秩序に迫る研究をしてみたいとの幻想をいだいている。

